Schädel-Hirn-Trauma
25.03.2020 -
Ein Kieler Molekül könnte die Reparatur von Nervenzellen vorantreiben.
Bei einem Schädel-Hirn-Trauma sterben je nach Schwere der Verletzung Nervenzellen im Gehirn in unterschiedlichem Umfang ab. Solche Hirnverletzungen können Konzentration, Entscheidungsfähigkeit, Lernen und Erinnerung einschränken. Ein Molekül, das Prof. Stefan Rose-John, Mitglied im Exzellenzcluster „Präzisionsmedizin für chronische Entzündungserkrankungen“ (PMI) und Leiter des Biochemischen Instituts der Christian-Albrechts-Universität zu Kiel (CAU), entwickelt hat, könnte einen Mechanismus in Gang bringen, der diese Schädigungen wieder repariert. Darauf deuten neue Forschungsergebnisse hin, die Rose-John gemeinsam mit internationalen Forschenden unter Leitung der University of Queensland im australischen Brisbane kürzlich in Cell veröffentlicht hat.
Die Forschenden untersuchten an Mäusen, wie das Immunsystem im Gehirn nach einer Verletzung mit den Hirnnervenzellen interagiert und wie dies die Lern- und Erinnerungsfähigkeit beeinflusst. „Bisher waren wir davon ausgegangen, dass bestimmte Immunzellen im Gehirn, die Mikroglia, nach einer Hirnverletzung Entzündungen im Gehirn vorantreiben und so zu kognitiven Einschränkungen führen“, berichtet die leitende Autorin der Arbeit, Dr. Jana Vukovic von der University of Queensland. „Als wir aber Mikroglia bei Mäusen gezielt entfernten, waren wir überrascht, dass sich ihr Verhalten und ihre Fähigkeit, Hirngewebe zu reparieren, dadurch nicht verbessert haben“, so Vukovic weiter. Das Forschungsteam hat daraufhin in Versuchstieren die verstärkte Bildung von neuen Mikroglia angeregt und festgestellt, dass dies die Reparatur der Nervenzellen antreibt. „Die neuen Mikroglia verbesserten die Lern- und Gedächtniskapazität der Mäuse, bewahrten den Gewebeverlust und stimulierten die Bildung von neuen Neuronen“, sagt Vukovic.
Interleukin-6 treibt Reparatur voran
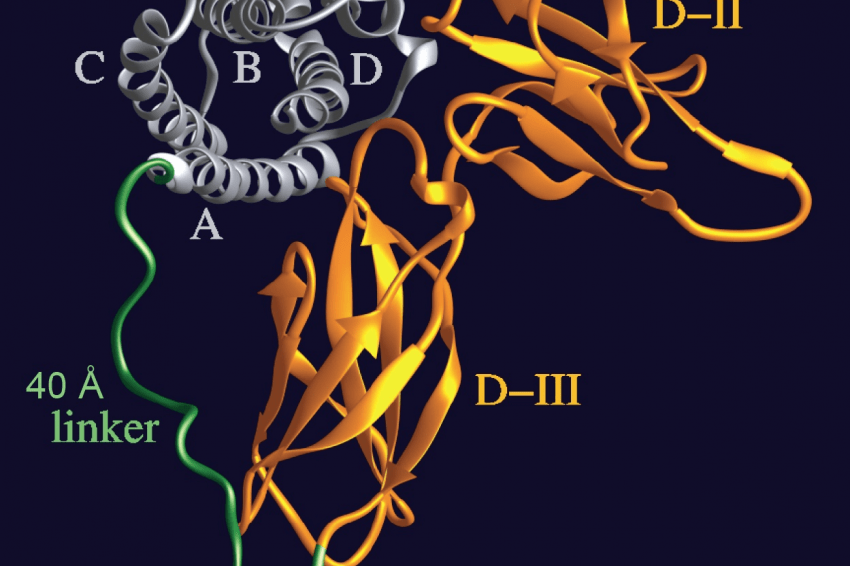
Treibende Kraft hinter diesem regenerierenden Prozess ist offenbar das Signalmolekül Interleukin-6 (IL-6): Als die Forschenden es im Versuch komplett blockierten, verschwand auch der regenerierende Effekt der Mikroglia. Erhöhten sie die Menge an vorhandenem IL-6, konnten sie den Prozess stimulieren. Das Signalmolekül ist ein wichtiger Botenstoff, der z.B. bei Entzündungsreaktionen Alarm schlägt, in dem es vermehrt ausgeschüttet wird und so Immunreaktionen reguliert. Er kann über zwei verschiedene Signalwege wirken: Beim „klassischen“ Signalweg bindet IL-6 spezifisch an einen Rezeptor, der nur auf bestimmten Zellen, wie etwa Leberzellen, vorkommt. Gemeinsam binden sie dann an eine weitere Rezeptoruntereinheit auf der selben Zelle, das gp130 Protein, und lösen so eine Reaktion in der Zelle aus. Über den alternativen sogenannten „IL-6-trans-Signalweg“ hingegen kann IL-6 unter bestimmten Umständen auf jede Zelle im Körper wirken. Der spezifische IL-6-Rezeptor kommt auch gelöst im Blut vor. IL-6 kann an diesen freien, im Blut zirkulierenden Rezeptor binden. Gemeinsam bindet der Komplex dann an einen gp130-Rezeptor, der auf allen Zellen vorhanden ist, und löst dadurch in der Zelle eine Reaktion aus.
Ein Designer-Molekül als molekulares Diagnose-Werkzeug
Rose-John hat diesen an vielen physiologischen Prozessen beteiligten trans-Signalweg entdeckt und Pionierarbeit in der Erforschung seiner zentralen Bedeutung geleistet. „Wir haben in den letzten Jahren einige molekulare Werkzeuge entwickelt, mit denen wir testen können, welcher Signalweg in einem bestimmten Krankheitsbild aktiv ist“, erklärt Rose-John. Zu diesen molekularen Werkzeugen gehört das künstliche Molekül „Hyper-IL-6“, welches auch in der aktuellen Studie zum Einsatz kam. Es besteht aus dem Signalmolekül Interleukin 6 (IL-6) und seinem spezifischen Rezeptor in gelöster, also nicht an eine Zelle gebundenen, Form. Zusammen bilden sie ein vollkommen neues Molekül, das es so in der Natur nicht gibt. Dieses neue Molekül stimuliert genau wie seine natürlich vorkommenden Einzel-Bestandteile den IL-6-trans-Signalweg, ist dabei aber deutlich wirksamer, da sich IL-6 und Rezeptor nicht mehr im Blut „finden“ müssen, wie in der Natur.
Regenerierung über IL-6-trans-Signalweg
In der aktuellen Studie zeigte Hyper-IL-6 einen positiven Effekt: Nach Gabe des Moleküls bei verletzten Nervenzellen bildeten sich wieder mehr Mikroglia, was wiederum zur Neubildung von Nervenzellen und schließlich zur Verbesserung der Symptome führte. „Die Ergebnisse zeigen, dass der neu entdeckte regenerierende Effekt der Mikroglia nach Hirnverletzungen über den trans-Signalweg von IL-6 ausgelöst wird“, sagt Rose-John. „Diese Beobachtung ist auch deshalb interessant, da bisher vollkommen unbekannt war, wie IL-6 im Gehirn wirkt.“
Die Ergebnisse könnten in Zukunft die Entwicklung neuer Medikamente zur Linderung von Lern- und Gedächtnisdefiziten nach Schädigungen von Nervenzellen ermöglichen. Damit bergen sie vielversprechende Potenziale zur Behandlung einer Vielzahl von neurologischen Erkrankungen wie Hirnverletzungen, Demenz oder anderen neurodegenerativen Krankheiten.
Kontakt
Christian-Albrechts-Universität - Exzellenzcluster Präzisionsmedizin für chronische Entzündungserkrankungen
24118 Kiel