Lungenschäden bei COVID-19-Erkrankungen verstehen
12.08.2021 - Forschende der Charité – Universitätsmedizin Berlin, des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und der Freien Universität Berlin haben die zellulären Mechanismen zu Beginn einer entzündlichen Lungenschädigung, ausgelöst durch eine SARS-CoV-2-Infektion, im Detail untersucht.
Verantwortlich für Schäden, die eine Beatmung notwendig machen, ist demnach nicht eine direkte Zerstörung der Lunge durch die Vermehrung des Virus. Vielmehr sind entzündliche Prozesse und das Endothel der Lunge maßgeblich an schweren Verläufen beteiligt, wie jetzt im Fachmagazin Nature Communications beschrieben ist.
Bei COVID-19 ist die Immunantwort entscheidend für die Schwere der Erkrankung. Was aber genau in der Anfangsphase der Krankheit in Lunge und Blut geschieht, war bislang unklar. Forschende der Charité – Universitätsmedizin Berlin, des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und der Freien Universität Berlin haben nun die zellulären Mechanismen zu Beginn einer entzündlichen Lungenschädigung, ausgelöst durch eine SARS-CoV-2-Infektion, untersucht. Verantwortlich für Schäden, die eine Beatmung notwendig machen, ist demnach nicht eine direkte Zerstörung der Lunge durch die Vermehrung des Virus. Vielmehr sind entzündliche Prozesse und das Endothel der Lunge maßgeblich an schweren Verläufen beteiligt, wie die Forschenden jetzt im Fachmagazin Nature Communications beschreiben.
Seit eineinhalb Jahren versuchen Forschende auf der ganzen Welt, die durch das Coronavirus SARS-CoV-2 verursachte Erkrankung COVID-19 zu verstehen. Bis heute gibt es nahezu keine Medikamente zur Behandlung der Krankheit, die zu akutem Lungenversagen führen und neben der Lunge weitere Organe und Organsysteme schädigen kann. Eine der Hürden: COVID-19 wird unter anderem durch eine fehlgeleitete, mitunter überschießende Reaktion des körpereigenen Immunsystems verursacht. Um therapeutische Angriffspunkte zu finden, ist es notwendig, im Detail zu verstehen, wie und wo genau welche nachteiligen Prozesse im Körper ausgelöst werden. Die patientenzentrierte Forschung stößt hierbei an Grenzen - vor allem wenn es darum geht, in der frühen Phase der Infektion Krankheitsmechanismen zu untersuchen. Biomaterial als Grundlage für Studien ist in der Regel erst nach Aufnahme in einem Krankenhaus zugänglich. Bei leichten oder mittelschweren Verläufen, verbunden mit einer Lungenentzündung, kann meist gar kein Gewebe aus der Lunge gewonnen werden – zu hoch wäre das Risiko für akut Erkrankte. Was bleibt, ist die Analyse von Zellgewebe nach dem Tod von COVID-19-Patientinnen oder -Patienten.
Anhand verfügbarer Patientenproben konnte das Team um Prof. Dr. Martin Witzenrath, Stellvertretender Direktor der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité, wertvolle Informationen über Mechanismen und Verlauf der Erkrankung gewinnen. Um darüber hinaus Lungenareale zu untersuchen, die sich bei Patientinnen und Patienten nicht ohne Weiteres betrachten lassen und Einblicke in die Frühphase der Erkrankung zu erhalten, war das Forschungsteam auf der Suche nach einem geeigneten Modell. In der internationalen COVID-19-Forschung wie auch bei der Erforschung des SARS-CoV-1 haben sich Hamstermodelle als aufschlussreich erwiesen. „Wir wollten wissen, ob die Modelle zur Entwicklung neuer Therapieansätze herangezogen werden können und haben versucht, Erkenntnisse aus Proben von Patientinnen und Patienten darin wiederzufinden. Das hat gut funktioniert“, sagt Prof. Witzenrath, Co-Letztautor der Studie. „Unser Interesse galt dabei insbesondere den Endothelzellen der Lunge, also der Barriere, die die Blutgefäße auskleidet. Diese verliert bei schwerem COVID-19 an Funktion, wodurch es schlussendlich zum Lungenversagen kommt.“
Gemeinsam mit Forschenden am Berliner Institut für Medizinische Systembiologie (BIMSB) des MDC, Virologen und Tiermedizinern der Freien Universität sowie Datenexperten des Berlin Institute of Health (BIH) in der Charité haben die Wissenschaftlerinnen und Wissenschaftler in ihrer aktuellen Arbeit eine genaue Charakterisierung der SARS-CoV-2-Infektion im Tiermodell vorgenommen und diese mit Datensätzen aus Proben von Patientinnen und Patienten untermauert. Die Analyse soll das derzeit wichtigste nicht transgene Modell für COVID-19, den Goldhamster, zur Entwicklung von Therapien nutzbar machen. Hamster infizieren sich mit denselben Virusvarianten wie Menschen. Auch entwickeln sie ähnliche Krankheitssymptome, und ihre Lunge wird bei einer schweren Erkrankung geschädigt. Dabei verläuft COVID-19 bei einzelnen Arten unterschiedlich. Während sie bei Goldhamstern in der Regel nur einen moderaten Verlauf nimmt, erkranken Roborovski-Zwerghamster schwer.
Woran das liegt und welche Prozesse sich in den Zellen der Lunge tatsächlich abspielen, haben unter anderem Einzelzellanalysen am BIMSB gezeigt. Die Forschenden lassen hierbei die einzelnen Zellen einer Probe über einen Chip laufen. Dort werden sie zusammen mit einem Barcode in kleine wässrige Tröpfchen verpackt. Auf diese Weise kann die RNA – der Teil des Erbgutes, den die Zelle gerade abgelesen hatte – sequenziert und später der Zelle wieder zugeordnet werden. Aus den gewonnenen Daten lässt sich mit hoher Präzision auf die Funktion der Zelle schließen. „So konnten wir beobachten, wie bestimmte Zellen des Immunsystems in der Lunge – die Monozyten und daraus entstehende Makrophagen – das Virus aufnehmen und sehr heftig reagieren. Sie senden Botenstoffe aus, die eine starke Entzündungsreaktion hervorrufen. In unserem Modell wird diese recht schnell wieder eingefangen, denn andere Immunzellen – die T-Zellen – schwärmen zu diesem Zweck aus. Bei schweren COVID-19-Verläufen geschieht das nicht“, erklärt Dr. Geraldine Nouailles, Wissenschaftlerin an der Medizinischen Klinik mit Schwerpunkt Infektiologie und Pneumologie der Charité und Co-Erstautorin der Studie. „Für eine erfolgreiche Genesung von COVID-19 ist eine schnelle und effiziente T-Zell-Antwort zentral.“
Während das Immunsystem im Zuge einer COVID-19-Erkankung in Aufruhr gerät, vermehrt sich SARS-CoV-2 in der Lunge und in den Zellen der Atemwege zunächst nur schwach. „Die Zerstörung des Lungengewebes bei schweren COVID-19-Verläufen wird nicht direkt durch die Vermehrung des Virus in den Zellen verursacht, sondern durch die starke Entzündungsreaktion“, erklärt MDC-Wissenschaftler Dr. Emanuel Wyler, ebenfalls Co-Erstautor. „Das scheint auf die Zellen der Blutgefäße, insbesondere die Endothelzellen in der Lunge, ebenfalls zuzutreffen. Sie reagieren stark auf das Virus, werden aber nicht von ihm infiziert und gehen nicht zugrunde.“ Nimmt die Krankheit einen schweren Verlauf, können verschlossene Blutgefäße und instabile Gefäßwände zu einem akuten Lungenversagen führen. Bei moderaten COVID-19-Erkrankungen dagegen spielen Gefäßschäden sehr wahrscheinlich keine Rolle. „Dass das Endothel, eine Art Schutzschild in den Gefäßen – das unter anderem verschiedene Prozesse in den Mikrogefäßen der Lunge regelt – bei COVID-19 aktiviert wird, hatten wir erwartet. Dass diese Zellen zugleich aktiver Motor der Entzündung sind, hat uns eher überrascht“, sagt Prof. Witzenrath. „Man könnte demnach auf zwei Arten therapeutisch an diesen für den Krankheitsverlauf zentralen Zellen angreifen. Zum einen mit Substanzen, die die Endothelbarriere abdichten. Zum anderen mit solchen, die das Endothel beruhigen. Eine davon erforschen wir bereits im Sonderforschungsbereich SFB-TR84 und konnten zeigen, dass sie bei Pneumonie und Beatmung erfolgreich ist.“ Aktuell ebenfalls getestete entzündungshemmende Medikamente gegen COVID-19 setzen an der Immunreaktion als solches an – sie wirken auch auf Monozyten und Makrophagen und bremsen ihre Aktivität.
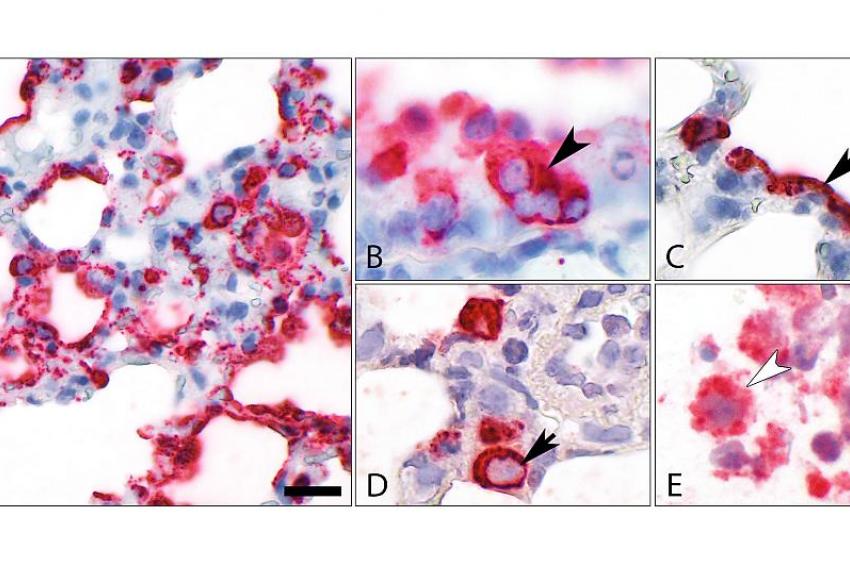
Das nun bestätigte Modell soll zur Entwicklung von wirksamen und sicheren Therapien bei COVID-19 beitragen. Ziel ist es, die Zahl von Patientinnen und Patienten mit schweren Lungenschäden zu reduzieren. Derzeit analysiert das multidisziplinäre Forschungsteam die Reaktionen der unterschiedlichen Zellarten im Roborovski-Zwerghamster. Die Forschenden wollen herausfinden, warum die Infektion hier schwerer verläuft und nicht selbstlimitierend ist wie im Fall des Goldhamsters. „Wir hoffen, dass wir damit auch einen Erklärungsansatz dafür finden, warum manche Menschen schwer an COVID-19 erkranken und andere nicht“, sagt Dr. Nouailles. Allerdings muss hierfür noch das Genom des Zwerghamsters entschlüsselt werden. Da Hamster in der Versuchstierkunde bislang eher als Exoten galten, bestehen noch einige Wissenslücken. „Teilweise konnten wir diese nun mit Informationen aus der aktuellen Untersuchung schließen. Das ist, auch im Sinne einer bewussten und gezielten Nutzung von Tieren in der medizinischen Forschung, ein großer Fortschritt“, erläutert Co-Letztautor Dr. Jakob Trimpert, Virologe und Tiermediziner an der Freien Universität Berlin. Mit seinem Team hat er die COVID-19-Hamstermodelle entwickelt und zusammen mit den Tierpathologen der FU Berlin unter Leitung von Prof. Dr. Achim Gruber die mikroskopischen Untersuchungen von infiziertem Lungengewebe durchgeführt. Diese histopathologischen Analysen haben wesentlich zu den Erkenntnissen der Studie beigetragen.
Über die Studie: Gefördert wurden die Arbeiten unter anderem durch die Deutsche Forschungsgemeinschaft (DFG) im Sonderforschungsbereich SFB-TR84, das Bundesministerium für Bildung und Forschung (BMBF) mit den Projekten CAPSyS-COVID sowie PROVID und das Berlin Institute of Health (BIH) in der Charité mit CM-COVID. Ebenfalls ermöglicht hat die Studie das BMBF-geförderte Nationale Forschungsnetzwerk der Universitätsmedizin zu Covid-19 (NUM), im Teilvorhaben NAPKON, einem umfassenden Pandemie-Kohortennetzwerk.
Kontakt
Charité-Universitätsmedizin Berlin
Charitéplatz 1
10117 Berlin
Deutschland
+49 30 450 50
+49 30 450 524902