Forschende entwickeln nebenwirkungsarmen therapeutischen Ansatz gegen aggressive Blutkrebs-Form
Forschende um Prof. Dr. Salih vom Deutschen Konsortium für Translationale Krebsforschung am DKFZ-Partnerstandort Tübingen haben mit Förderung der Wilhelm Sander-Stiftung in Höhe von 528.000 € über 6 Jahre ein innovatives Immunzytokin (therapeutischer Antikörper mit einem daran gekoppelten Zytokin) entwickelt.
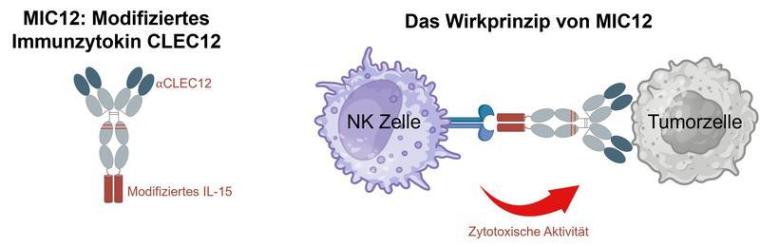
Das „modifizierte Immunzytokin“ (MIC-Molekül) aktiviert gezielt Immunzellen gegen Leukämiezellen und kann die schwerwiegenden Nebenwirkungen vermeiden, die bisher verfügbare Immunzytokine auslösen. In Labor- und Tiermodellen zeigten die MIC-Moleküle eine starke und vor allem gezielte Immunaktivierung gegen die Leukämie – ein vielversprechender Schritt in Richtung klinische Anwendung.
Die akute myeloische Leukämie (AML) ist eine der aggressivsten Formen von Blutkrebs. Die Erkrankung führt zu einem unkontrollierten Wachstum unreifer Blutzellen im Knochenmark, verdrängt die gesunde Blutbildung und hat eine schlechte Prognose: Weniger als die Hälfte der erwachsenen Patientinnen und Patienten überlebt länger als fünf Jahre. Neue Immuntherapien sollen das körpereigene Abwehrsystem gezielt gegen Krebszellen mobilisieren.
Ein Forschungsteam um Prof. Dr. Helmut Salih, Ärztlicher Direktor der Klinischen Kooperationseinheit Translationale Immunologie am Universitätsklinikum Tübingen, hat ein bahnbrechendes Molekül entwickelt: ein neuartiges Immunzytokin. Dabei handelt es sich um ein gentechnisch erzeugtes Eiweißmolekül, das einen Antikörper und einen Immunbotenstoff (Zytokin) vereint. Das Besondere: Das Team hat das potente Zytokin Interleukin-15 (IL-15) so modifiziert, dass es inaktiv bleibt, solange der Antikörperteil nicht an eine Leukämiezelle gebunden ist. Erst wenn der Antikörperteil des Moleküls eine Krebszelle erkennt, wird das IL-15 aktiv und stimuliert das Immunsystem – ein völlig neuer therapeutischer Ansatz.
Klassische Immunzytokine und IL-15-Therapien scheitern an einem fundamentalen Problem: Die durch diese ausgelöste Immunaktivierung ist unspezifisch, führt zu massiven Nebenwirkungen und macht therapeutisch wirksame Dosen damit unmöglich. Mit der „zielzellrestringierten Aktivierung" steht nun ein eleganter Lösungsansatz zur Verfügung.
Überzeugende präklinische Ergebnisse
Die entwickelten MIC-Moleküle erzielten im Labor und in Tiermodellen außerordentliche Ergebnisse:
• deutlich gesteigerte Aktivierung von Immunzellen im Vergleich zu konventionellen Antikörpern.
• drastisch reduzierte unerwünschte Immunaktivierung.
• verlängertes Überleben ohne Anzeichen von Toxizität.
„Unser Ziel war es, die potente immunstimulierende Wirkung von IL-15 erstmals effektiv für die Krebstherapie nutzbar zu machen - ohne die bisherigen Nebenwirkungen. Unsere Ergebnisse zeigen, dass das gelingen kann“, erklärt Prof. Dr. Helmut Salih, dessen Forschungsgruppe im Deutschen Konsortium für Translationale Krebsforschung (DKTK) am DKFZ-Partnerstandort Tübingen angesiedelt ist. „Das motiviert uns, diesen Ansatz weiter in Richtung klinischer Anwendung zu entwickeln.“
Breites Anwendungspotenzial
Die erarbeiteten Ergebnisse eröffnen nicht nur neue Möglichkeiten für die Behandlung der AML, sondern auch für andere Krebsarten. Das Projekt baut auf früheren Arbeiten der Tübinger Forschenden auf. Diese haben bereits Fc-optimierte Antikörper mit verbesserter Immunaktivierung entwickelt und klinisch getestet. Die Verbindung mit der IL-15-Signalgebung schafft nun eine Plattform für eine noch wirksamere, kontrollierte und präzise Immuntherapie.
Nächste Schritte
Mit der erfolgreichen präklinischen Validierung von MIC12 wurde ein wichtiger Meilenstein auf dem Weg zur klinischen Anwendung erreicht. Die Ergebnisse bilden eine solide Grundlage für klinische Studien zur Prüfung von Sicherheit und Wirksamkeit bei Patientinnen und Patienten.
Das von der Wilhelm Sander-Stiftung geförderte Projekt leistet somit einen bedeutenden Beitrag zur Entwicklung innovativer, gezielter und nebenwirkungs-armer Immuntherapien gegen Blutkrebs.