Neue Einblicke in die menschliche Immunabwehr gegen Pockenviren
Ein internationales Forschungsteam unter der Beteiligung des Universitätsklinikums Bonn (UKB) und der Universität Bonn hat einen wichtigen Beitrag zum Verständnis der menschlichen Immunabwehr gegen Pockenviren geleistet.
Die Wissenschaftlerinnen und Wissenschaftler konnten erstmals zeigen, dass verschiedene menschliche Zelltypen Pockenviren über unterschiedliche Sensoren erkennen, um damit Entzündungsreaktionen auszulösen. Gleichzeitig entwickelte das Team die weltweit ersten Nanobodies, die den DNA-Sensor AIM2 gezielt blockieren können – ein Werkzeug, das neue Möglichkeiten für die Entzündungs- und Infektionsforschung eröffnet. Das Paper wurde nun in The EMBO Journal publiziert.
Pockenviren, wie das historische Variolavirus (Erreger der echten Pocken), das Vacciniavirus (Grundlage der Pockenimpfung) oder das aktuell relevante Monkeypoxvirus (Erreger von Mpox), besitzen große Doppelstrang-DNA-Genome, die nach der Infektion im Zellinneren freigesetzt werden. Das menschliche angeborene Immunsystem erkennt solche DNA als Gefahrensignal und kann sogenannte Inflammasome assemblieren – große Proteinkomplexe, die eine starke Entzündungsreaktion und schließlich den kontrollierten Zelltod auslösen. Bisher war jedoch unklar, welcher der beiden bekannten DNA-Sensoren – AIM2 oder NLRP3 – diesen Alarmweg in menschlichen Zellen tatsächlich auslöst. Frühere Studien hatten hier widersprüchliche Ergebnisse geliefert.
Die Forschenden aus Bonn und Boston konnten dieses Rätsel nun lösen. Mit eigens konstruierten Vacciniaviren, die einen fluoreszierenden Inflammasom-Reporter tragen, untersuchten sie die Reaktionen verschiedener menschlicher Primärzellen. Dabei zeigte sich ein überraschend klares Bild: Während menschliche Makrophagen und Keratinozyten der Haut das virale Erbgut über den Sensor AIM2 erkennen, reagieren Monozyten stattdessen über NLRP3. Damit wird erstmals deutlich, dass die Aktivierung von Inflammasomen im Menschen zelltypspezifisch erfolgt. „Unser Immunsystem unterscheidet je nach Zelltyp, welcher Alarmweg genutzt wird“, erklärt Studienleiter Prof. Florian Schmidt vom Institut für Angeborene Immunität am UKB und Mitglied im Transdisziplinären Forschungsbereich (TRA) „Life and Health“ der Universität Bonn. „Diese Spezialisierung war so bisher nicht bekannt.“
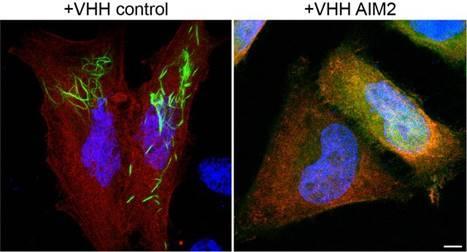
Um diese Prozesse eindeutig nachweisen zu können, entwickelte das Team erstmals AIM2-spezifische Nanobodies – winzige Antikörperfragmente, die innerhalb von Zellen funktionieren. Diese Nanobodies binden direkt an die entscheidende Domäne von AIM2 und verhindern, dass der Sensor die für die Inflammasombildung notwendigen Filamente ausbildet. Bivalente Varianten, bei denen zwei Nanobodies verbunden sind, zeigten dabei eine besonders starke Hemmwirkung. In gentechnisch modifizierten Vacciniaviren produziert, blockieren sie den AIM2-Alarmweg bereits während der Infektion selbst. Mithilfe dieses Tricks konnten Untersuchungen auch in sehr kurzlebigen Zellen wie Monozyten durchgeführt werden, die im Labor aus menschlichem Blut isoliert wurden. Die Forschenden konnten so klar nachweisen, dass bestimmte Zelltypen ausschließlich über AIM2 reagieren, andere dagegen unabhängig davon funktionieren. „Diese Nanobodies sind ein völlig neues Werkzeug, um die Rolle von AIM2 in Infektionen und Entzündungserkrankungen präzise zu untersuchen“, sagt Prof. Schmidt.
Die Studie zeigt außerdem, dass auch das Monkexpoxvirus (MPXV) Inflammasome in menschlichen Hautzellen und Immunzellen aktivieren kann – wenn auch schwächer als das Vacciniavirus. Dies deutet darauf hin, dass MPXV bestimmte Immunreaktionen möglicherweise besser umgehen kann, was für die Analyse aktueller Ausbrüche wichtig ist.
Die neuen Erkenntnisse liefern ein deutlich verbessertes Verständnis darüber, wie der menschliche Körper DNA-Viren erkennt und welche Entzündungsmechanismen dabei eine Rolle spielen. Sie können langfristig helfen, zielgerichtete Therapien gegen Fehlregulationen des Immunsystems zu entwickeln, wie sie etwa bei Autoimmunerkrankungen oder chronischen Entzündungen auftreten. Zudem schaffen die entwickelten Nanobodies und Reporterviren neue experimentelle Möglichkeiten für die internationale Infektionsforschung.
Beteiligte Institutionen und Förderungen:
Neben der Universität Bonn und dem Universitätsklinikum Bonn war die Harvard Medical School an der Studie beteiligt. Gefördert wurde die Studie durch die Deutsche Forschungsgemeinschaft (DFG) (TRR237, Emmy Noether Programm, Exzellenzcluster EXC2151) und die Boehringer Ingelheim Stiftung (Rise Up!).